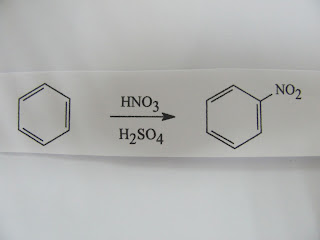
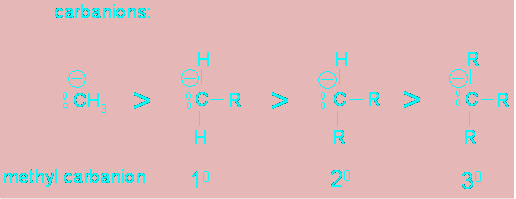ปฏิกิริยาเคมีอินทรีย์
ปฏิกิริยาเคมีของสารประกอบอินทรีย์
เรียก A, B ว่า สารตั้งต้น (starting material) และ
C, D ว่าสารผลิตภัณฑ์ (product)
• ในปฏิกิริยาเคมีอินทรีย์ บางครั้งจะเรียกสารตั้งต้นตัวหนึ่งว่า reactant หรือsubstrate และเรียก
สารที่เข้าทำปฏิกิริยาว่า reagent
• ส่วนใหญ่ reagent มักเป็นสารประกอบอนินทรีย์หรือสารประกอบอินทรีย์โมเลกุลเล็ก
• ในการเกิดปฏิกิริยาเคมีอินทรีย์จะมีการแตกพันธะซึ่งอาจเป็น 1 พันธะหรือมากกว่า
และมีการสร้างพันธะใหม่ 1 พันธะหรือมากกว่า
• ปฏิกิริยาอาจเกิดขั้นตอนเดียวหรือหลายขั้นตอน
• การแสดงรายละเอียดของขั้นตอนต่าง ๆ ของปฏิกิริยาที่เกิดขึ้น เรียกว่า กลไกของปฏิกิริยา (reaction mechanism)
การแตกพันธะของสารประกอบอินทรีย์
อาจเกิดได้ 2 แบบ
1. แบบโฮโมไลติก (homolytic cleavage) เป็นการแตกพันธะอย่างสมมาตร กล่าวคือ เมื่อแตกพันธะแต่ละอะตอมจะเอาอิเล็กตรอนไปอะตอมละ1 อิเล็กตรอน ปฏิกิริยาที่มีการแตกพันธะ แบบโฮโมไลติก เรียกว่า ปฏิกิริยาแบบอนุภาคหรืออนุมูลอิสระ (radical or free-radical reaction)
2. แบบเฮเทอโรไลติก (heterolytic cleavage) เป็นการแตกพันธะที่อะตอมหนึ่งเอาอิเล็กตรอนไป 2
อิเล็กตรอน และอีกอะตอมหนึ่งไม่มีอิเล็กตรอนเลย ทำให้อะตอมหนึ่งมีประจุบวก อีกอะตอมหนึ่ง
ที่มีประจุลบ ปฏิกิริยาที่มีการแตกพันธะแบบเฮเทอโรไลติก เรียกว่า ปฏิกิริยาแบบไอออนิก
(ionic reaction)
สารมัธยันตร์
1. 1. คาร์โบเคตอิออน (carbocation) หรือ คาร์โบเนียมอิออน (carbonium ion) ใช้ sp2 ไฮบริดออร์บิตัล
เสถียรภาพของคาร์โบเคตอิออน (carbocation)
2. คาร์แบนอิออน (carbanion) เป็นคาร์บอนที่มีประจุลบ มีอิเล็กตรอนวงนอก 8 อิเล็กตรอน
คาร์แบนอิ ออน ใช้ sp3 ไฮบริดออร์บิตัล
เสถียรภาพของคาร์แบนอิออน จะตรงข้ามกับคาร์โบแคตอิออน
3.เรดิคัลอิสระ (free radical) เป็นคาร์บอนที่มีอิเล็กตรอนเดี่ยว ไม่มีประจุ มีอิเล็กตรอนวงนอก 7 อิเล็กตรอน คาร์บอนที่เป็นเรดิคัลอิสระ ใช้ sp2 ไฮบริดออร์บิตัล
1. เสถียรภาพของเรดิคัลอิสระ
4. คาร์บีน (carbene) เป็นสารมัธยันตร์ของคาร์บอนที่มีเพียง 2 พันธะ มีอิเล็กตรอนวงนอก 6
อิเล็กตรอน คาร์บีนมี 2 ชนิด